

Стехиометрические уравнения показывают, в каких соотношениях реагенты вступают во взаимодействие. Они имеют вид:
![]() ,
,
где: ![]() – исходные вещества;
– исходные вещества; ![]() – продукты реакции;
– продукты реакции;
![]() … - стехиометрические
коэффициенты.
… - стехиометрические
коэффициенты.
Химические
превращения могут быть описаны
одним или несколькими
стехиометрическими
уравнениями. В случае, когда
имеет место несколько
стехиометрических уравнений,
стехиометрический коэффициент
i-го вещества, j-го
уравнения, можно обозначить,
как ![]() и систему уравнений
можно представить в виде:
и систему уравнений
можно представить в виде:
![]() , где n – число реагентов,
m – число уравнений ,
, где n – число реагентов,
m – число уравнений , ![]() – для исходных
реагентов,
– для исходных
реагентов, ![]() – для
продуктов,
– для
продуктов, ![]() – для
i-го вещества, не входящего в
j-ое уравнение.
– для
i-го вещества, не входящего в
j-ое уравнение.
Совокупность стехиометрических уравнений, однозначно и полно описывающих процесс, называют базисной системой стехиометрических уравнений. Так как со стехиометрическими уравнениями можно делать линейные преобразования (складывать уравнения, переносить члены справа налево и наоборот и т.д.), то возникают трудности при определении базисной системы уравнений, например: процесс получения водорода из природного газа можно записать двумя уравнениями:
![]() ,
,
но можно эти уравнения сложить и тогда:
![]() .
.
Для расчета данного процесса не достаточно последнего уравнения, хотя оно и является суммой предыдущих. Таким образом, базисная система линейно-независимых стехиометрических уравнений, однозначно описывающих процесс, должна включать все участвующие в химическом превращение вещества и не должна включать ни одного уравнения, которое может быть получено линейными преобразованиями других.
В
большинстве случаев
необходимое число
стехиометрических уравнений
можно определить по формуле: У=В-Э,
где У - число независимых
уравнений, В - число веществ
(реагентов), Э- число
химических элементов из
которых состоят реагенты. Так
для конверсии метана В=5 ![]() ; Э=2
; Э=2 ![]() , откуда У=2.
Базисная система включает два
уравнения. Для отдельных
обменных процессов формула
имеет вид: У=В-Э+1.
, откуда У=2.
Базисная система включает два
уравнения. Для отдельных
обменных процессов формула
имеет вид: У=В-Э+1.
Основные виды технологических расчетов, которые могут быть выполнены только на основе стехиометрических зависимостей:
расчет материальных (массовых) балансов процесса;
расчет многих технологических показателей (степень превращения, селективность, и пр.);
расчет скорости превращения различных веществ в данных условиях.
Знание стехиометрических уравнений позволяет установить: как соотносятся между собой степени превращения, рассчитанные по разным веществам. Так для реакции вида:
![]()
по определению:
![]() ;
; ![]() .
.
Если
исходные вещества взяты в
стехиометрическом
соотношении, то степени
превращения по всем исходным
реагентам равны, т.е. ![]() . А
если какое-то вещество взято в
избытке (например, В) по
сравнению со
стехиометрическим количеством
в n раз, то степень превращения
будет в n раз меньше, чем
степень превращения другого
вещества:
. А
если какое-то вещество взято в
избытке (например, В) по
сравнению со
стехиометрическим количеством
в n раз, то степень превращения
будет в n раз меньше, чем
степень превращения другого
вещества: ![]() .
.
Стехиометрические закономерности позволяют получить более удобные для практического расчета выражения для выхода продукта и селективности. Для реакции вида:
![]()
выход по продукту R будет равен:
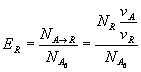 ,
,
для селективности S:
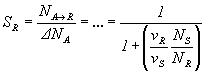 .
.