

Схема превращения описывает наиболее вероятные пути взаимодействия и превращения веществ. Она может быть представлена системой химических уравнений или графически.
Схема превращений в виде системы химических уравнений отражает механизм реакции, т.к. показывает между какими веществами реально происходит взаимодействие, и какие продукты при этом образуются. Поэтому схема превращений не может быть выбрана произвольно и не всегда совпадает со стехиометрическими уравнениями, например: окисление аммиака описывается двумя стехиометрическими уравнениями:
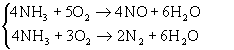
Этих двух уравнений достаточно для стехиометрических расчетов, но по ним нельзя судить о механизме превращения. Если предположить, что реакция протекает только по этим двум уравнениям, то следовало бы сделать вывод: когда аммиак полностью израсходуется, то реакция прекратится и количество NO и N2 перестанет изменяться. Однако экспериментальные исследования показали, что в отсутствии аммиака, происходит разложение NO и наиболее вероятные пути превращения веществ для данного процесса описываются уравнениями:

Система (1)-(4) и будет схемой превращения при окислении аммиака. В схеме превращений уравнений больше, чем линейно независимых стехиометрических уравнений. Схема превращений может быть представлена и графически, так для процесса окисления аммиака схема имеет вид:
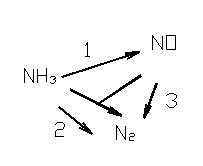
Рис.4. Схема превращений при окислении аммиака
Каждый путь превращения (1-4) называют этапом или частной реакцией. Знание схемы превращений необходимо для правильной организации процесса.
Интенсивность превращения веществ характеризуется скоростью превращения. Скорость превращения вещества – это количество данного вещества, которое превращается (расходуется или образуется) в единицу времени в единице объема реакционного пространства:
![]() .
.
Скорость превращения может быть рассчитана:
на единицу объема (для гомогенных процессов);
на единицу поверхности (для гетерогенных процессов);
на единицу объема катализатора (для каталитических процессов).
Скорость
превращения может
определяться по любому
веществу, участвующему в
реакции, при этом принимают: ![]() - если вещество
расходуется,
- если вещество
расходуется, ![]() - если
вещество образуется, и
- если
вещество образуется, и ![]() - если вещество не
реагирует в реакции (инертное).
Итак, для реакции:
- если вещество не
реагирует в реакции (инертное).
Итак, для реакции:
![]() .
.
Если
реакция сложная, то различают:
общую скорость превращения
вещества ![]() и
скорость превращения по этапу
и
скорость превращения по этапу ![]() :
:
![]() , где m – количество
этапов, j – номер этапа.
, где m – количество
этапов, j – номер этапа.
Например,
для реакции типа: ![]() , где вещество А
превращается по двум этапам,
общая скорость превращения
вещества А будет:
, где вещество А
превращается по двум этапам,
общая скорость превращения
вещества А будет:
![]()
Зная скорость превращения одного вещества можно посчитать скорость другого, для этого достаточно знать уравнения химического превращения. Скорости превращения различных веществ относятся как стехиометрические коэффициенты при соответствующих веществах. Если разделить скорость превращения каждого вещества на стехиометрический коэффициент при нем в уравнении реакции:
![]() .
.
Эту
величину и принимают за меру
интенсивности процесса и
называют скоростью химической
реакции ![]() . Таким образом:
. Таким образом: ![]() .
.
По
физическому смыслу скорость
реакции совпадает со скоростью
превращения того вещества, для
которого значение
стехиометрического
коэффициента = 1. Скорость
реакции ![]() не
относится к какому либо
конкретному веществу и всегда
положительна. По величине
не
относится к какому либо
конкретному веществу и всегда
положительна. По величине ![]() можно посчитать, какова
скорость превращения любого
вещества. Для сложных реакций,
имеющих несколько этапов,
существует несколько
скоростей, соответствующих
каждому этапу:
можно посчитать, какова
скорость превращения любого
вещества. Для сложных реакций,
имеющих несколько этапов,
существует несколько
скоростей, соответствующих
каждому этапу: ![]() 1,
1, ![]() 2,
… .
2,
… .
Тогда
скорость превращения для
отдельно взятого вещества
реакции можно будет определить
как: ![]() .
.