

В промышленности процессы в системе “Г-Т” протекают с образованием только газообразных продуктов, только твердых продуктов, газообразных и твердых.
Примерами
таких процессов являются: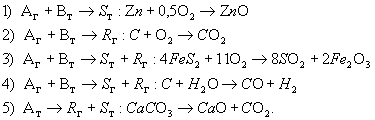
Гетерогенный процесс “Г-Т” с образованием
только газообразных продуктов
Для
такой системы характерным
является уравнение ![]() . Рассмотрим данную
систему в соответствии с
этапами, приведенными выше.
. Рассмотрим данную
систему в соответствии с
этапами, приведенными выше.
Общая
схема процесса. Твердая
шарообразная частица
омывается потоком газа с
концентрацией реагента А в
нем ![]() .
.
Для составления в дальнейшем математической модели необходимо выбрать физическую модель, т.е. схему соответствующую реальному явлению.
Для
данной системы часто
используют две модели:
квазигомогенная и модель с
невзаимодействующим ядром. По квазигомогенной
модели предполагается, что
химическое превращение
происходит во всем объеме
твердой фазы, и по мере
прохождения процесса
концентрация ![]() снижается равномерно по всему
объему.
снижается равномерно по всему
объему.
По другой модели считается, что вещество В реагирует с А только на поверхности, внутрь твердой частицы газообразное вещество не проникает (ядро не взаимодействует). Размеры частицы при этом уменьшаются, но концентрация вещества. В внутри ядра остается постоянной да полного исчезновения частицы.
Квазигомогенная модель больше соответствует гетерогенно-каталитическим процессам с твердым катализатором, т.к. обычно катализатор обладает развитой внутренней поверхностью (множество пор) и там процесс действительно может протекать во всём объеме.
Некаталитические процессы “Г-Т” точнее отражает модель с невзаимодействующим ядром. При дальнейшем рассмотрении процесса остановимся на второй модели. Будем считать, что твердая частица (вещество В) реагирует с А на своей поверхности. По мере протекания процесса происходит выгорание частицы, продукт R приходит в газовую фазу и уносится с потоком.
Структура процесса показана на рис. 2:
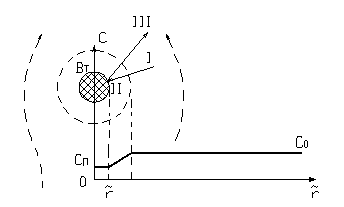
Рис. 2.
Схема гетерогенного процесса с
реакцией ![]()
Обтекающий
частицу поток хорошо перемешан
в объеме, так что концентрации
А в потоке одинаковы и равны ![]() . При обтекании частицы
потоком образуется
пограничный слой у поверхности
частицы (показано пунктиром),
который определяет
коэффициент масссобмена
. При обтекании частицы
потоком образуется
пограничный слой у поверхности
частицы (показано пунктиром),
который определяет
коэффициент масссобмена ![]()
![]() между объемом потока и
поверхностью частицы.
между объемом потока и
поверхностью частицы.
Считается
поверхность частицы
равнодоступной, так что
толщина пограничного слоя и,
следовательно, величина ![]() одинакова по всей
поверхности частицы. Для
рассмотрения принимаем, что
температура частицы и в потоке
одинаковы.
одинакова по всей
поверхности частицы. Для
рассмотрения принимаем, что
температура частицы и в потоке
одинаковы.
Обозначим:
![]() – начальный
радиус частицы (в начальный
момент времени);
– начальный
радиус частицы (в начальный
момент времени); ![]() -
текущий радиус частицы (в
момент времени t)
-
текущий радиус частицы (в
момент времени t)
В ходе
процесса ![]() уменьшается – частица
выгорает. Уменьшение размера
частиц происходит медленнее,
чем установление процессов
переноса, так что последние
можно рассматривать
установившимися и описывать
как стационарный массообмен.
Это позволяет рассматривать
отдельно процессы для
газообразных и твердых
реагентов. В газовой фазе
выделим следующие стадии
(составляющие) процесса (см.
рис. 2):
уменьшается – частица
выгорает. Уменьшение размера
частиц происходит медленнее,
чем установление процессов
переноса, так что последние
можно рассматривать
установившимися и описывать
как стационарный массообмен.
Это позволяет рассматривать
отдельно процессы для
газообразных и твердых
реагентов. В газовой фазе
выделим следующие стадии
(составляющие) процесса (см.
рис. 2):
перенос реагента А из газовой фазы через пограничный слой к поверхности твердой частицы (этап I). Для этого концентрация А у поверхности
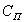 должна быть
меньше, чем в потоке
должна быть
меньше, чем в потоке 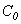 ;
;реакция А с В на поверхности частицы (этап II). Реакция протекает при концентрации
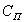 ;
;Перенос продуктов реакции от поверхности частицы в поток (этап III).
В твердой фазе можно выделить два явления (составляющие процесса):
реакция между А и В на проворности;
Уменьшение размера частицы.
Составление математической модели. Математическое описание должно содержать как минимум:
выражение для расчета наблюдаемой скорости превращения;
зависимости, количественно отражающие ход процесса: изменение размеров (радиуса) частицы в зависимости от времени превращения (t)

степень превращения твердого вещества однозначно связна с радиусом частицы. В зависимости (1) можно выразить
 через степень
превращения ХВ и получить
зависимость
через степень
превращения ХВ и получить
зависимость
![]()
Основой для получения зависимостей является материальный баланс. Составление баланса по веществу А основано на рассмотрении процесса как многостадийного. Стадии пространственно разделены и совершаются последовательно во времени. В установившемся режиме скорости этапов должны быть равны.
Обозначим:
![]() - скорость переноса
вещества А из потока к
поверхности;
- скорость переноса
вещества А из потока к
поверхности; ![]() - скорость собственно
химического превращения на
поверхности частицы.
- скорость собственно
химического превращения на
поверхности частицы.
![]()
![]()
где ![]() - коэффициент
массообмена;
- коэффициент
массообмена; ![]() -
движущая сила;
-
движущая сила; ![]() -
поверхность частицы радиусом
-
поверхность частицы радиусом ![]() .
.
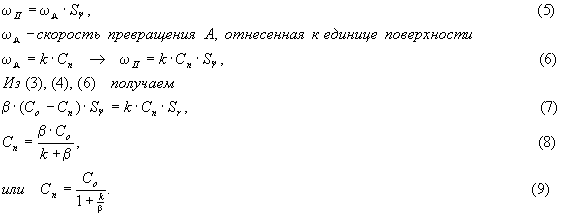
Наблюдаемая
скорость превращения ![]() (относится также к единице
поверхности) определяется так:
(относится также к единице
поверхности) определяется так:

Найдем связь между временем превращения и текущим радиусом частицы. В общем случае скорость превращения вещества В
![]()
где ![]() -
стехиометрические
коэффициенты.
-
стехиометрические
коэффициенты.
![]()
С
другой стороны ![]()
где ![]() - количество вещества В
в твердой фазе.
- количество вещества В
в твердой фазе.
![]() ,
,
где V
- объем частицы; ![]() – количество
вещества В в единице объема,
тогда
– количество
вещества В в единице объема,
тогда![]()
где ![]() - поверхность частицы
радиусом
- поверхность частицы
радиусом ![]() - объем твердого
вещества, исчезнувший за счет
того, что за время
- объем твердого
вещества, исчезнувший за счет
того, что за время ![]() “выгорает” шаровой слой
толщиной
“выгорает” шаровой слой
толщиной ![]() :
:![]()
Подставим (14) и (17) в (13’) получим
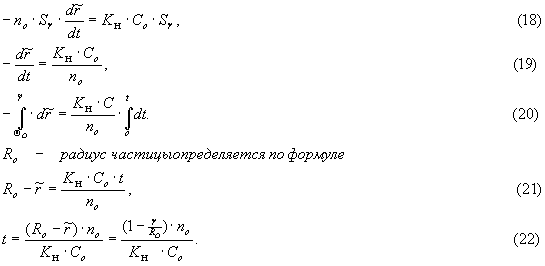
Если ввести безразмерный радиус
![]()
![]()
При
полном превращении частицы ![]() время полного
превращения
время полного
превращения
![]()
Разделим (24) на (25)

На
практике части удобнее связать
время t со степенью превращения
твердого вещества ![]() .
.
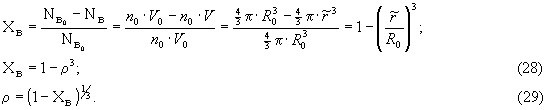
Подставив (29) в (26), получим
![]()
Анализ
зависимости ![]() для
гетерогенного процесса,
протекающего в различных
режимах:
для
гетерогенного процесса,
протекающего в различных
режимах:
а) кинетический
режим. При таком режиме
наименее интенсивна стадия
химического превращения, т.е. ![]()
Наблюдаемая
константа скорости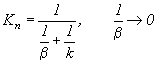
превратится в константу скорости химической реакции К.
Из
выражения 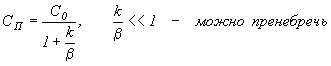 .
.
![]() .В этом случае
распределение концентрации
представим на рис. 3а). Процесс
идет при максимально возможной
в данном случае концентрации
на поверхности
.В этом случае
распределение концентрации
представим на рис. 3а). Процесс
идет при максимально возможной
в данном случае концентрации
на поверхности ![]() .
.
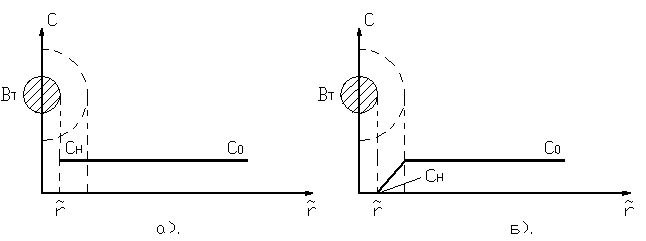
Рис.3. Распределение концентрации газообразного режима для процесса Г-Т: а) кинетический режим; б) диффузионный режим
б) диффузионный
режим. Интенсивность
реакции в этом случае много
больше интенсивности переноса,
т.е ![]() . В этом случае
. В этом случае ![]() превратится в b . В уравнении
превратится в b . В уравнении ![]() b мало по сравнению
с
b мало по сравнению
с ![]() . Распределение
концентрации представлено на
рис. 3б).
. Распределение
концентрации представлено на
рис. 3б).
Наблюдаемая
скорость записывается
фактически уравнением
скорости переноса, т.к. ![]() – движущая сила
процесса переноса
– движущая сила
процесса переноса ![]() при условии
при условии ![]() и не зависит от стадии
химической реакции.
и не зависит от стадии
химической реакции.
Лимитирующая стадия – этап сложного процесса, у которого минимальная интенсивность, определяемая коэффициентом скорости этапа.
Пути интенсификации процесса “Г-Т”.
![]() . Чем интенсивнее
процесс, тем меньше
. Чем интенсивнее
процесс, тем меньше ![]() . Для уменьшения
. Для уменьшения ![]() :
:
а)
уменьшение ![]() , т.е.
измельчение твердого
материала;
, т.е.
измельчение твердого
материала;
б)
повышение концентрации
реагента в газовой фазе ![]() .
.
Некоторые
меры эффективны только для
определенного режима. Так,
нужно повышать ![]() , но для
каждого режима
, но для
каждого режима ![]() имеет
свой смысл
имеет
свой смысл ![]() – для
диффузионного и кинетического.
Поэтому при диффузионном
режиме дает эффект увеличение
скорости обтекания частицы
газом
– для
диффузионного и кинетического.
Поэтому при диффузионном
режиме дает эффект увеличение
скорости обтекания частицы
газом ![]() , а при
кинетическом – повышении
температуры
, а при
кинетическом – повышении
температуры ![]() .
.